Waterstof
de kleinste atoom met de grootste invloed
Waterstof is geen energiebron maar een energiedrager met eigenschappen, het kent vele toepassingen maar op dit moment gaat vooral de aandacht uit naar energie en gezondheidsvraagstukken
Wat is waterstof?
Waterstof (Hydrogen) is het meest voorkomende en het kleinste (scheikundige) element (H) in het heelal. In de scheikunde wordt dit element dan ook aangetoond met atoomnummer 1. Hydrogen is een gas dat in normale omstandigheden niet in geïsoleerde vorm voor komt. Dit omdat het de eigenschap heeft zich altijd te verbinden met andere elementen. Het kent een hoge reactiviteit, is smaakloos, geurloos en een ontvlambaar.

Waterstof, de vader van alle elementen!

Waterstof ontdekt?
Waterstof werd rond 1671 voor het eerst in beschreven door de Iers-Engelse chemicus Robert Boyle naar aanleiding van een reactie tussen ijzer en verdund zuur. Pas In 1766 ontdekte Henry Cavendish dat het een chemisch element betrof. Alhoewel hij de chemische eigenschappen nauwkeurig kon beschrijven was hij van mening dat het gas voortkwam uit het metaal in plaats van het zuur. Hij noemde het element dan ook: brandbaar gas van metalen.
Later gaf Antoine Lavoisier waterstof zijn huidige Latijnse naam Hydrogenium. Dit woord komt voort uit een samenstelling van twee Griekse woorden: hydor (water) en genes (maken). Vrij vertaald betekent waterstof dus watermaker. Van Hydrogenium is het symbool H in het periodiek systeem afgeleid.
Waterstof in ons leven
Meer dan 90% van alle atomen in de kosmische openbaring zijn waterstofatomen, ze vormen meer dan 75% van de atomaire massa in het universum. Gaswolken van waterstofmoleculen staan aan de oorsprong van stervorming en dus ook aan het ontstaan van onze aarde. Door de reactieve eigenschappen en interactie van verschillende waterstof-isotopen ¹H (protium), ²H (deuterium) en ³H (tritium) speelt dit element het een primaire rol voor het op gang brengen van kernfusieprocessen binnen het kosmisch manifest. Hierbij komen enorme hoeveelheden energie vrij. Bij deze processen ontstaat ook het gas helium.
Een groot deel van de waterstofatomen die op aarde voorkomen, zijn gebonden in water. Een watermolecuul (H2O) bestaat uit twee waterstofatomen en een zuurstofatoom. Verder komen waterstofatomen veel voor in organische verbindingen en fossiele brandstoffen. Methaan dat als bijproduct ontstaat bij de afbraak van organisch materiaal, is een belangrijke leverancier van deze energievorm/brandstof voor de industrie. Alles wat leeft bestaan uit waterstofverbindingen. Als u meer wilt weten over de rol van dit bijzondere gas in relatie tot onze gezondheid klik dan hier.

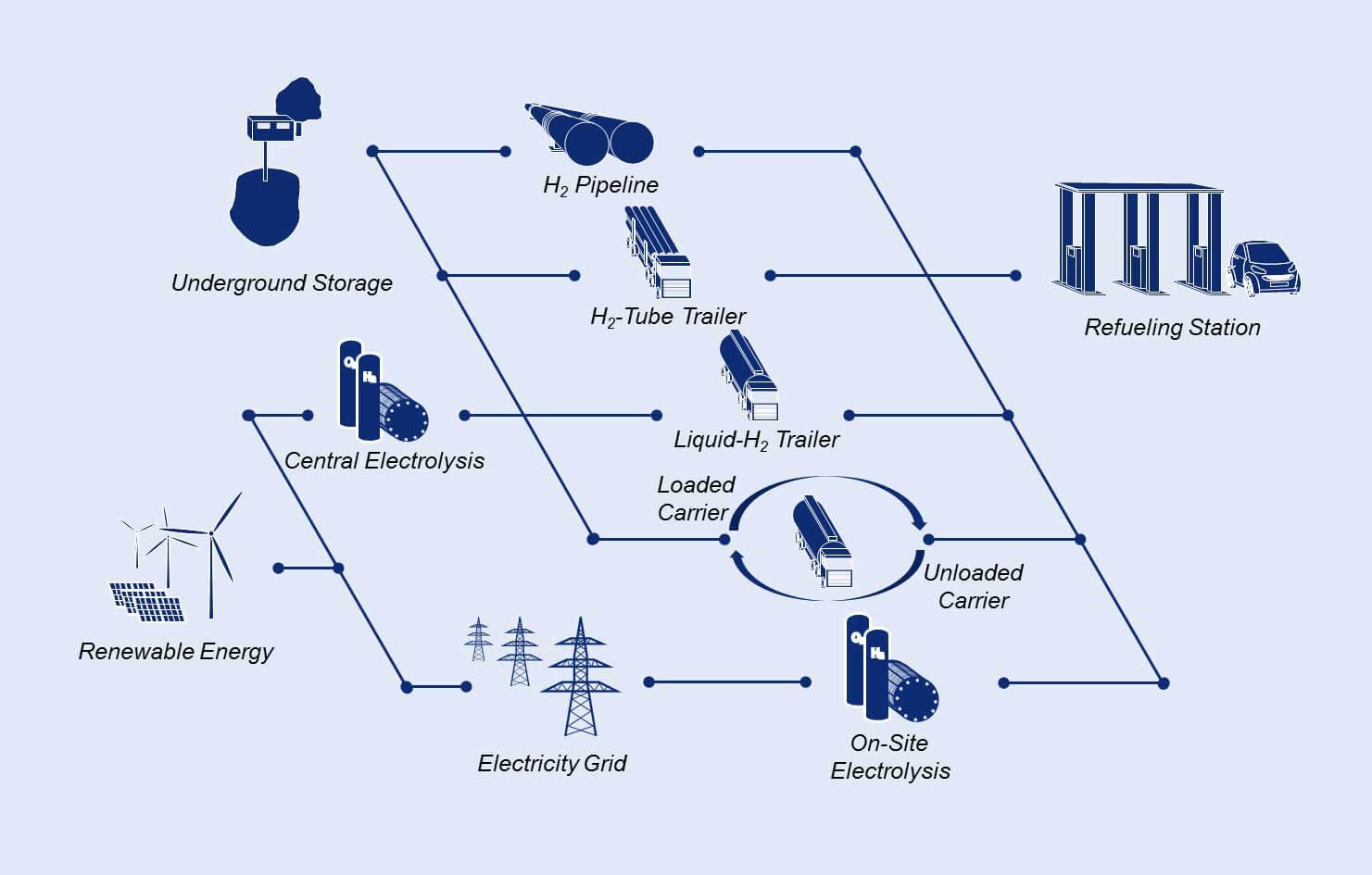
Waterstof toepassingen
De meest bekende toepassingen van waterstof zijn misschien wel als energieproduct in de vorm van kernfusie, raketbrandstof (Space Shuttle) en als brandstof voor auto’s. Omdat waterstof geen schadelijk verbrandingsgassen geeft, wordt veel onderzoek gedaan naar de toepassing als brandstof in auto’s. Het eerste bekende voertuig dat op waterstof reed deed dat in 1959. Het was een omgebouwde tractor met een 15 kW brandstofcel.
In 2001 verscheen de eerste auto met brandstofcel, met een opslagtank die geschikt was voor 700 bar druk. Het voordeel van deze ontwikkeling was dat met minder ruimte meer waterstof kon worden meegenomen. Dit vergrootte de praktische toepasbaarheid.
Verder kent waterstofgas in de stabiele samenstelling van H2 ook medische toepassingen (Molecular Hydrogen) en ook hier wordt veel onderzoek naar gedaan met veelbelovende resultaten. Inmiddels wat er ook gekeken of het als vervanger voor aardgas kan worden toegepast, maar het zal nog wel even duren voordat.
